三氯氧磷(POCl₃)作为氯化剂 | 脱羟基氯化反应!
三氯氧磷(POCl₃)作为氯化剂 | 脱羟基氯化反应!

化学性质
POCl₃ 的化学行为可概括为“四副面孔”:
- 遇水即“爆炸”——水解生成磷酸和盐酸,并伴随剧烈放热与大量 HCl 白雾。
- 遇醇/酚即“酯化”——把醇羟基变成磷酸酯键,瞬间“穿上”三甲基等新外套。
- 遇酰胺即“脱水刀”——抽掉一分子水,把 RCONH₂ 直接“剪”成 RCN。
- 遇羟基即“氯化器”——把 –OH 换成 –Cl,羧酸、酰胺等含氧官能团秒变氯化衍生物。
因其活泼的化学性质,在有机合成中常被作为重要的工具试剂广泛应用,如:
氯化剂(1、将羧酸转化为酰氯(如 RCOOH + POCl₃ → RCOCl + H₃PO₄ + HCl);2、酚类化合物的氯化(如苯酚与 POCl₃反应生成 2,4,6 - 三氯苯酚);
脱水剂(1、酰胺脱水制腈(如 RCONH₂ + POCl₃ → RCN + POCl₂(OH) + HCl);2、醇类脱水制烯烃(较少用,更多用于特定结构脱水)。
磷酸化试剂(制备磷酸酯类化合物,如农药、阻燃剂的中间体)。
同时需要注意POCl₃遇水剧烈反应,与有机物接触可能引发燃烧;接触皮肤、眼睛会导致严重灼伤,吸入其蒸气可损伤呼吸道黏膜;LD₅₀(大鼠口服)约为 55 mg/kg,属于高毒物质。
在操作过程中一定要做好安全防护,佩戴防腐蚀手套、护目镜、防毒面具(在通风橱中操作);避免与水接触,反应容器需干燥;滴加时缓慢加入,控制反应温度。 皮肤不慎接触后立即用大量清水冲洗,再用稀碳酸氢钠溶液洗涤;吸入蒸气需迅速转移至空气新鲜处,就医。
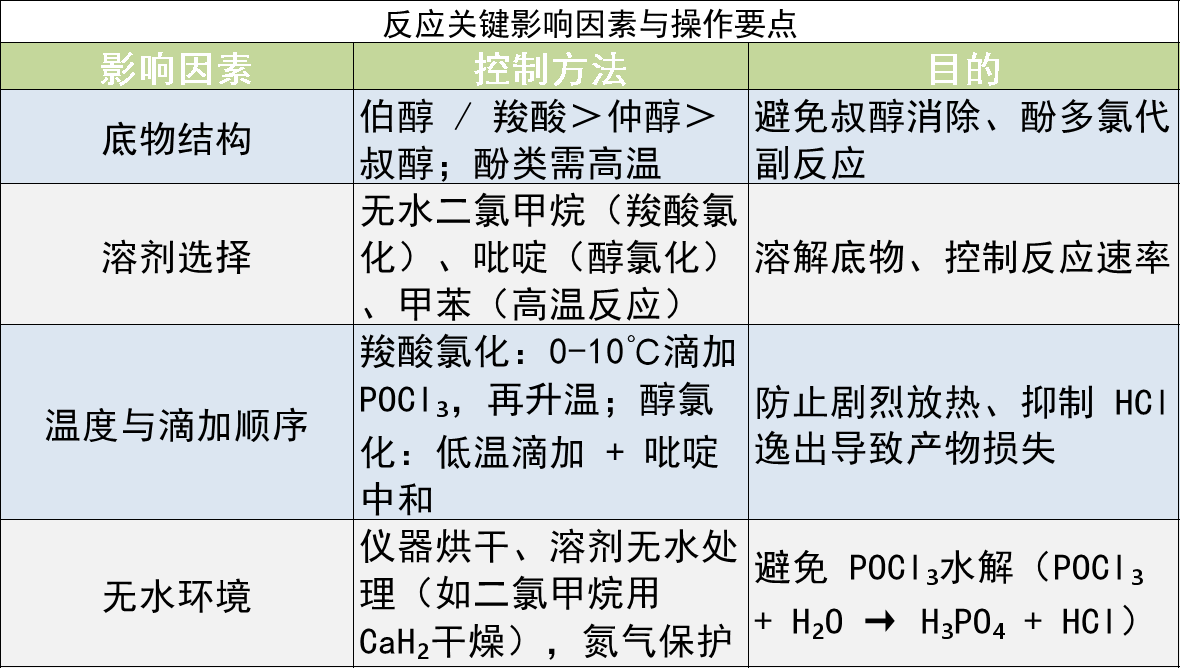
脱羟基氯化反应的核心是POCl₃通过亲核取代与脱水作用,将 - OH 转化为 - Cl,由于 - OH 并不是一个容易离去的基团,首先POCl₃与 - OH 形成磷氧键(-OPOCl₂),使羟基成为易离去基团。 然后体系中的 Cl⁻(来自 POCl₃ 解离或外加碱)进攻碳正离子,取代 - OPOCl₂,伴随磷酸衍生物(如 HPOCl₂)的生成,最终释放氯代产物。反应通常以DIPEA、TEA、N,N-二甲基苯胺等作为碱加快质子的解离;甲苯、DMF和无水DCM等作为溶剂,也可以使用大量的POCl₃充当溶剂。
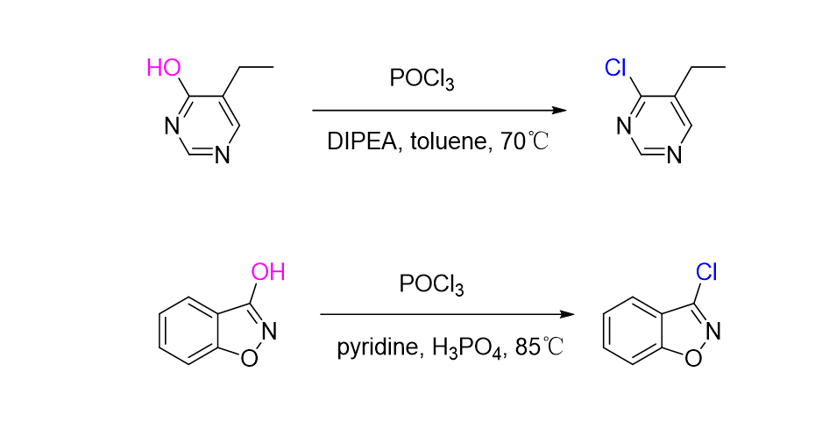
吡啶、嘧啶等杂芳环上只有氮原子的邻对位羟基容易发生脱羟基氯化,间位不能发生反应;酚羟基也很难发生脱羟基氯化。 杂芳环的氮原子邻对位烷氧基可与 POCl₃ 反应直接转化为相应芳卤,无需预先裂解醚到酚再卤化。
反应案例
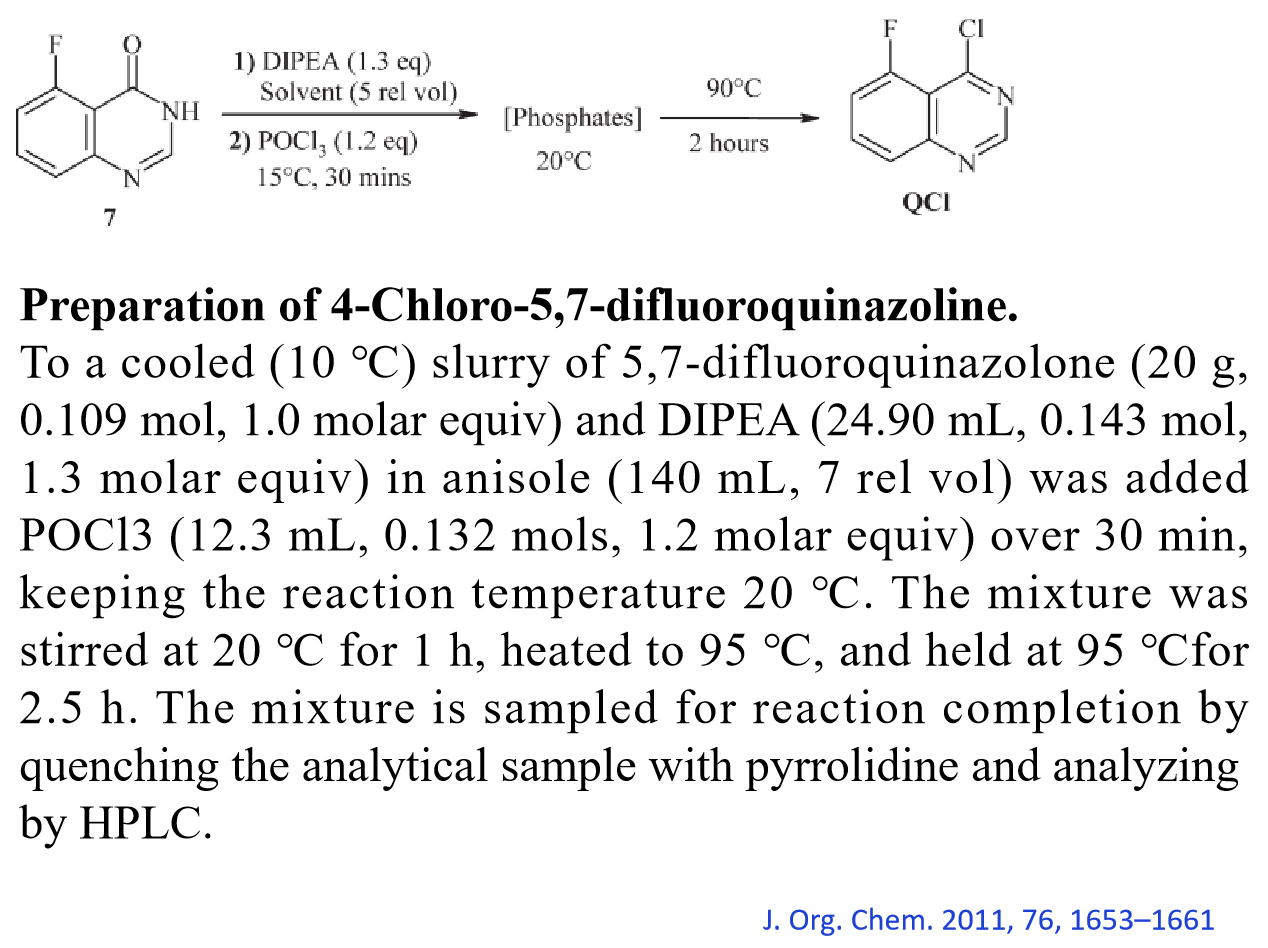

工艺放大改进
脱羟基氯化反应一般使用大大过量的POCl₃ 做溶剂,几克的小反应并没有太大问题,但当反应需要放大,做到公斤级,大量的POCl₃ 会造成后处理困难和安全隐患。因此,在放大反应时可以考虑加入其它溶剂(甲苯,氯苯等),此时,一般只需要加入1~2 eq 的 POCl₃ ,使得POCl₃ 的使用量大大减少。
脱羟基氯化反应时间一般较长,有时候会一直停留在中间态难以反应完全。此时,可在反应体系中加入添加剂(如 LiCl/HCI , DIPEA , DABCO 等),以维持体系中一定的氯离子浓度,促进反应由中间态向最终产物转化,进而加快反应速度。
常见的脱羟基氯化反应一般需要加热到POCl₃ ,回流。对于一些不稳定的反应物,可能会造成反应结果杂乱,副产物增多。此时,可以考虑在反应体系中加入 NMM ( N ﹣甲基吗啡啉)做催化剂
操作要点
无水环境控制:所有仪器需提前烘干,溶剂(如二氯甲烷、甲苯)需经无水处理;反应体系可通入干燥氮气保护,避免空气中水分干扰。
温度与滴加顺序:羧酸氯化通常在低温(0-10℃)滴加 POCl₃,再升温至室温反应;禁止将 POCl₃一次性加入底物中,以防剧烈放热和气体逸出导致喷溅。
溶剂与催化剂:常用溶剂:二氯甲烷、氯仿、甲苯(极性非质子溶剂);碱性催化剂(如吡啶)可中和 HCl,提高反应速率(尤其适用于醇的氯化)。
后处理:反应结束后,将混合液缓慢倒入冰水中水解过量 POCl₃,并用碱(如 Na₂CO₃)中和酸性;有机相用分液漏斗分离,经干燥、蒸馏得到目标产物。
废液处理:反应液缓慢倒入冰水中,用 Na₂CO₃中和至 pH 7-8,分液后有机相回收,水相经处理后排放;过量 POCl₃需先用乙醇淬灭(POCl₃ + 3C₂H₅OH → OP (OC₂H₅)₃ + 3HCl),再中和处理。

免责声明:所载内容来源互联网,等公开渠道,我们对文中观点保持中立,仅供参考,交流之目的。转载的稿件版权归原作者和机构所有,如有侵权,请联系我们删除。
作者:

