|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
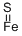
CAS号:1317-37-9
|
英文名称:Iron(II) sulfide (hexagonal)
分子式
分子量
EINECS号
MDL
Smiles
InChIKey
乙二醇化学百科
基本信息
物化性质
安全信息
生产及用途
硫化亚铁是一种由硫和铁2种元素形成的化合物,暗褐色或黑色块状结晶或颗粒,大块的有金属光泽。相对密度为4.74,熔点为1193~1199℃。不溶于氨,难溶于水,易溶于稀酸,放出有毒的硫化氢气体。在潮湿空气中,逐渐被氧化成四氧化三铁和硫黄。在其晶体结构中,硫原子为六方密堆积,铁原子处在位于顶角的6个硫原子的包围中,成八面体结构,而硫原子则处在6个以三方棱柱体顶角位置的铁原子包围中。铁、硫原子配位数均为6,原子个数比为1:1。  硫化亚铁可在2价铁盐中加入碱金属硫化物而得到。工业上用铁屑和硫磺粉混合后在高真空石英封管内经高温反应制取。在实验室中,主要用于制取硫化氢气体,用做分析试剂。工业上用来制陶瓷及油漆和颜料。还用它来制取其他亚铁盐。在高温下,硫化亚铁能被氧或臭氧氧化成铁的氧化物或硫酸盐;能被碳或金属锰还原成单质铁。硫化亚铁溶于氧化性酸生成三价铁盐和硫、二氧化硫或硫酸;溶于非氧化性酸生成二价铁盐和硫化氢。在高温下,硫化亚铁能被氧或臭氧氧化成铁的氧化物或硫酸盐;能被碳或金属锰还原成单质铁。  硫化亚铁溶于氧化性酸生成三价铁盐和硫、二氧化硫或硫酸;溶于非氧化性酸生成二价铁盐和硫化氢。 4FeS+6HNO3+6H2SO4 = 2Fe 2(SO4)3+ 3N2O3+ 4S↓+9H2O FeS + 6HNO3=Fe(NO)3+H2SO4+3NO+2H2O 2FeS + 10H2SO4(浓)=Fe2(SO4)3 +9SO2+10H2O FeS+H2SO4(稀) = FeSO4 +H2S FeS+ 2HCl=FeCl2+H2S 硫化亚铁与盐类或氧化物发生下列反应:  由铁和硫在高真空石英封管内共熔(1000℃)而得或将可溶性硫化物加到中性或碱性亚铁盐溶液中制得硫化亚铁。鸡蛋营养丰富,煮食鸡蛋是最简单、最能保持其营养的方法,但要把鸡蛋煮得恰到好处,既软硬适中,又不夹生是要掌握好火候和时间的。如果鸡蛋煮的时间过长,蛋黄中的亚铁离子就会与蛋白中的硫离子结合,生成一种叫硫化亚铁的物质,而硫化亚铁是很难被人体吸收利用的,从而降低鸡蛋的营养价值。因此,煮鸡蛋不宜时间过长,最好的方法是:鸡蛋冷水下锅,水煮开后再煮5分钟即可。 由铁和硫在高真空石英封管内共熔(1000℃)而得或将可溶性硫化物加到中性或碱性亚铁盐溶液中制得硫化亚铁。鸡蛋营养丰富,煮食鸡蛋是最简单、最能保持其营养的方法,但要把鸡蛋煮得恰到好处,既软硬适中,又不夹生是要掌握好火候和时间的。如果鸡蛋煮的时间过长,蛋黄中的亚铁离子就会与蛋白中的硫离子结合,生成一种叫硫化亚铁的物质,而硫化亚铁是很难被人体吸收利用的,从而降低鸡蛋的营养价值。因此,煮鸡蛋不宜时间过长,最好的方法是:鸡蛋冷水下锅,水煮开后再煮5分钟即可。用途 用作分析试剂用途 实验室制备硫化氢,陶瓷工业。
上下游产品
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
本网站展示的所有产品仅用于工业制造、技术研发、科学研究,所有产品非药品不可食用,依据国家相关法规及平台管理要求,购买相关危险物品应取得有效的资质、资格条件。 参考《应急管理部等多部门关于加强互联网销售危险化学品安全管理的通知 (应急〔2022〕119号)》 和《互联网危险物品信息发布管理规定》 Copyright © 2021-2025 chemhome123版权所有 |冀ICP备2024096099号- 1|冀公安备13042302000143号|互联网增值电信业务经营许可证:冀B2-20250121 |药品、 医疗器械互联网信息服务备案凭证备案号:(冀)-非经营性-2025-0099 |


 CAS号:152126-31-3
CAS号:152126-31-3 CAS号:29082-91-5
CAS号:29082-91-5 CAS号:2498-50-2
CAS号:2498-50-2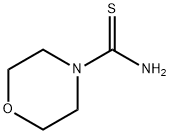 CAS号:14294-10-1
CAS号:14294-10-1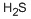 CAS号:7783-06-4
CAS号:7783-06-4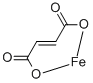 CAS号:141-01-5
CAS号:141-01-5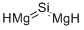 CAS号:22831-39-6
CAS号:22831-39-6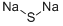 CAS号:1313-82-2
CAS号:1313-82-2 CAS号:1308-56-1
CAS号:1308-56-1 CAS号:463-58-1
CAS号:463-58-1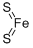 CAS号:12068-85-8
CAS号:12068-85-8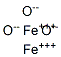 CAS号:1317-60-8
CAS号:1317-60-8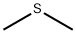 CAS号:75-18-3
CAS号:75-18-3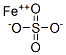 CAS号:7720-78-7
CAS号:7720-78-7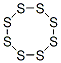 CAS号:1309-36-0
CAS号:1309-36-0