|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
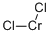
CAS号:10049-05-5
|
英文名称:Chromium(II) chloride
分子式
分子量
EINECS号
MDL
Smiles
InChIKey
乙二醇化学百科
基本信息
物化性质
安全信息
生产及用途
氯化铬,化学式 CrCl3。分子量158.36。深绿色结晶粉末。易溶于水,溶于乙醇,不溶于乙醚。与水长时间沸腾后成绿色溶液。加热分解。在空气中灼热则变为三氧化二铬。在氯气流中可升华,和四氯化碳在400℃下共热可以得到动力学惰性的紫色无水物。六水物有深绿色、浅绿色和紫色三种变体,在水溶液中都变成深绿色和紫色混合物,但在DMSO,DMF,乙醇等有机溶剂中呈现墨绿色。  高温下由三氧化二铬和碳粉的混合物和氯气作用或盐酸与氢氧化铬作用制得。用作制取其他铬盐的中间体、媒染剂、颜料及镀铬等。氯化铬是较硬的路易斯酸。其中含 d3 构型的三价铬,对于配体置换反应来说是惰性的。为了提高其活性,可以加入少量的还原剂(如锌 / 盐酸),将其还原为氯化亚铬,很快发生配体交换反应,然后使其与氯化铬 通过氯桥发生电子转移,获得相应的配合物,并再生成少量活性的Cr(II),直至所有Cr(III)都发生了取代反应。 化学性质 氯化铬又名三氯化铬。①CrCl3=158.36, 紫色三方晶体。相对密度2.76(15/4℃),在950℃升华,高于1300℃时开始离解。②CrCl3·6H2O=266.45,深绿色晶体,有潮解性。相对密度1.84 (7.5/4℃),熔点83℃。③CrCl3·10H2O=338.51,绿色结晶性粉末。相对密度1.76。三者都能溶于水和乙醇,不溶于乙醚。在空气中灼烧变为三氧化二铬。在600℃下,氯气通过氧化铬与碳的混合物或盐酸与氢氧化铬反应均可制得。用作分析试剂、织物媒染剂、烯烃聚合催化剂,制备其它铬盐和镀铬溶液的原料等。用途 氯化铬用于制铬盐、镀铬和作媒染剂等。与碘仿和四乙基乙二胺一起使用,将末端烯烃以高产率转化成反式碘代环丙烷。 用于制备双(茚基)铬二聚体和相关产品。 调控醛与三取代氯烯烃的缩合。用于合成乙烯低聚反应所需的高活性预催化剂。 在氢作用下与其他金属卤化物气相共还原生成细分的金属互化物,它们可用作具有有效的热电性、磁性和抗氧化性的结构材料或化合物。生产方法
1.原料无水三氯化铬,在干燥的氯气或氯化氢气流中于800℃下进行升华精制。而混在其中的三氯化铁,因在低温时先升华而可以清除。反应管可采用直径25mm、长500mm的一端封闭石英管或超硬质玻璃管,出口附近宜拉成缩颈,便于以后封闭。在开口处装上开有二孔的硅橡胶塞子,并插入通至底部的导气管和排气管。预先将反应管加热至500℃,减压使其完全干燥。把反应管横放,在管之末端,平铺上5g经升华精制的无水三氯化铬CrCl3,接着以每分钟50mL的流速通入不含氧的氯化氢和氢(1∶1)的混合气。反应管置于电炉中,在500℃下加热,即发生还原反应。使红紫色的原料全部变成白色后放冷,用氮气置换管内的气体,将导气管拉至出口处,然后封闭反应管。
2.
方法一〔将10克锌粉,0.8克氯化汞、10毫升水和0.5毫升浓盐酸的混合物激烈振荡5分钟,倾出上层清液,留下锌汞齐粉。另加20毫升水和2毫升浓盐酸,鼓泡通入二氧化碳气,使能搅动混合物,然后分批加入5克氯化铬,即得蓝黑色溶液。在二氧化碳气中贮存待用。
方法三在赤热温度下,用氢气处理三氯化铬,即得无水氯化铬 类别 有毒物质毒性分级 中毒急性毒性 口服- 大鼠 LD50: 1870 毫克/ 公斤可燃性危险特性 可烧; 火场产生有毒含铬化物烟雾;储运特性 库房低温, 通风, 干燥灭火剂 水, 二氧化碳, 干粉, 砂土职业标准 TWA 0.5 毫克(铬)/立方米
上下游产品
相关产品
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
本网站展示的所有产品仅用于工业制造、技术研发、科学研究,所有产品非药品不可食用,依据国家相关法规及平台管理要求,购买相关危险物品应取得有效的资质、资格条件。 参考《应急管理部等多部门关于加强互联网销售危险化学品安全管理的通知 (应急〔2022〕119号)》 和《互联网危险物品信息发布管理规定》 Copyright © 2021-2025 chemhome123版权所有 |冀ICP备2024096099号- 1|冀公安备13042302000143号|互联网增值电信业务经营许可证:冀B2-20250121 |药品、 医疗器械互联网信息服务备案凭证备案号:(冀)-非经营性-2025-0099 |


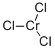 CAS号:10025-73-7
CAS号:10025-73-7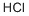 CAS号:7647-01-0
CAS号:7647-01-0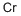 CAS号:7440-47-3
CAS号:7440-47-3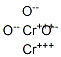 CAS号:1308-38-9
CAS号:1308-38-9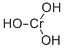 CAS号:1308-14-1
CAS号:1308-14-1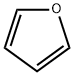 CAS号:110-00-9
CAS号:110-00-9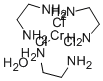 CAS号:16165-32-5
CAS号:16165-32-5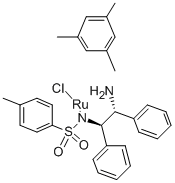 CAS号:174813-82-2
CAS号:174813-82-2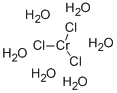 CAS号:10060-12-5
CAS号:10060-12-5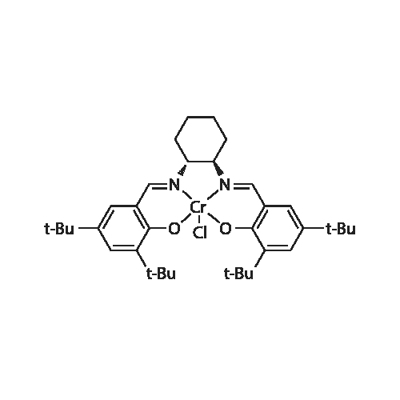 CAS号:164931-83-3
CAS号:164931-83-3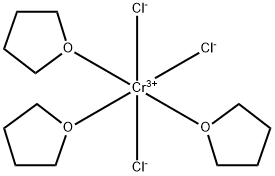 CAS号:10170-68-0
CAS号:10170-68-0 CAS号:10534-88-0
CAS号:10534-88-0 CAS号:15096-41-0
CAS号:15096-41-0 CAS号:219143-92-7
CAS号:219143-92-7 CAS号:14977-61-8
CAS号:14977-61-8