斯坦福赵芮可团队Nature发文:毫微旋转器助力,血栓清除取栓成功率大增
斯坦福赵芮可团队Nature发文:毫微旋转器助力,血栓清除取栓成功率大增
血管阻塞引发的急性中风、心梗等危重症治疗面临重大挑战。传统机械取栓技术(如支架取栓)对纤维蛋白含量高的血栓效果有限,且存在碎片化风险。斯坦福大学研发的新型Milli-spinner取栓装置采用旋转力学原理,通过压缩和剪切作用重构血栓内部结构,有效解决大体积致密血栓清除难题。实验证实该技术具有快速疏通血管、操作安全等优势,为卒中及肺栓塞等急症提供了更优治疗方案。
这项突破性研究于2025年6月4日刊登于《Nature》,论文题为"Milli-spinner thrombectomy"。研究团队由斯坦福大学机械工程系主导,常一隆博士担任第一作者,赵芮可教授负责通讯指导。吴帅博士(2019-2024届)作为第二作者参与研究,医学院放射科Jeremy J. Heit副教授等学者共同完成了此项工作。
血栓栓塞治疗迎来颠覆性突破
开发的取栓新技术,成功率较现有手段提升一倍以上。这项突破有望显著改善中风、心脏病、肺栓塞等血栓性疾病的治疗效果。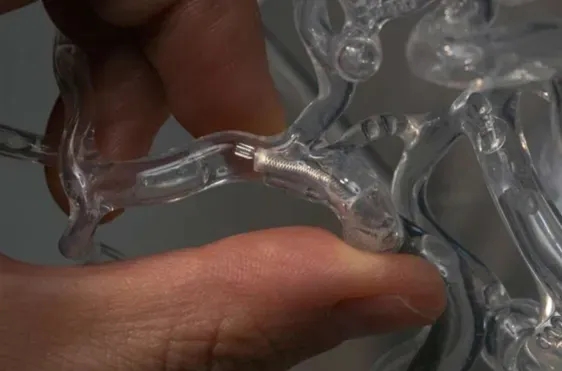
毫微旋转器特写:可高速旋转的中空导管,其血栓接触端设有特殊鳍片与狭缝结构,能产生局部负压。创新设计使其能在不破坏血栓的前提下缩小栓体。
在治疗缺血性中风时,时间至关重要。医生清除血栓的速度越快,脑细胞存活越多,患者康复机会越大。然而,现有技术首次取栓成功率仅50%,约15%的病例会完全失败。斯坦福大学赵芮可教授团队开发的“毫微旋转器取栓术”显著提升了取栓成功率。通过流体模型和动物实验验证,该技术在清除顽固血栓方面表现卓越,首次尝试开通率可达90%,远高于现有设备的11%。这一突破性技术有望彻底改变中风等血栓性疾病的治疗格局。
攻克缠结难题
血栓的核心结构是纤维蛋白交织红细胞形成的致密网状物。传统取栓技术(如真空抽吸或支架抓捕)容易造成血栓碎裂,引发二次栓塞。赵芮可团队研发的微旋取栓装置创新性地采用力学重构策略:通过导管末端设计的旋转结构产生复合力学场,使纤维蛋白在压缩-剪切协同作用下发生致密化重构。这种"旋转压实"机制既避免了传统方法的碎裂风险,又能显著减小血栓体积,其原理类似于将松散纤维揉捻成紧实线团的过程。该技术通过微创导管介入实现,为临床取栓提供了更安全有效的解决方案。

赵芮可教授
赵芮可教授团队证实,该技术可将血栓体积压缩至原始状态的5%。红细胞从纤维网络中释放后恢复自由流动,微型化的纤维蛋白球则被吸入导管排出体外。 赵芮可教授指出:无论血栓成分或大小,该技术均表现卓越。即便现行技术束手无策的致密纤维蛋白血栓,我们也能通过这种简单而强大的力学原理实现高效处理。
从意外发现到临床曙光
这项设计源于赵芮可教授在微型机器人领域的研究。原本用于体内药物递送的折叠式游泳机器人,其带鳍片狭缝的旋转中空结构意外被发现能产生局部负压。

赵芮可教授与Jeremy J. Heit教授在人体循环系统模型演示毫微旋转器植入
赵芮可团队在实验中发现,负压作用下血栓会发生神奇的形态转变——颜色由红转白并快速收缩。这一意外现象促使他们深入探索,最终研发出革命性的微旋取栓技术。通过数百次改进,该装置不仅能高效处理血栓,其无缆版本更有望实现血管内自主导航治疗。目前团队已成立公司推进临床转化,并拓展该技术在肾结石清除等领域的应用潜力。赵教授指出,其核心创新在于通过力学重构而非物理破坏来处理血栓,这将大幅提升治疗安全性。临床试验即将启动,有望为血管疾病治疗带来突破性进展。
图文介绍
这项研究提出了一种创新性的微旋血栓清除技术(Milli-spinner thrombectomy),专门针对动脉/静脉血栓引发的危重病症(如中风、心梗等)。其核心技术突破在于通过机械重构方式使纤维蛋白网络致密化并释放红细胞,实现血栓体积的有效缩减。相比传统方法,该技术能更完整地清除血栓,同时避免碎片化导致的二次栓塞风险,为血栓性疾病治疗提供了更安全高效的解决方案。
Milli-spinner 工作原理
Milli-spinner血栓清除技术采用独特的机械压缩机制,通过旋转装置产生的复合力学作用重构血栓结构。其工作原理包含三个关键环节:首先,旋转产生负压吸附血栓;其次,压缩-剪切协同作用使纤维蛋白网络致密化;最后,释放红细胞使血栓体积缩减达95%。这种物理重构方式避免了传统方法导致的碎裂风险,最终形成的高密度纤维蛋白核心更易于抽吸清除。该技术实现了血栓清除从"物理破坏"到"结构重构"的范式转变。
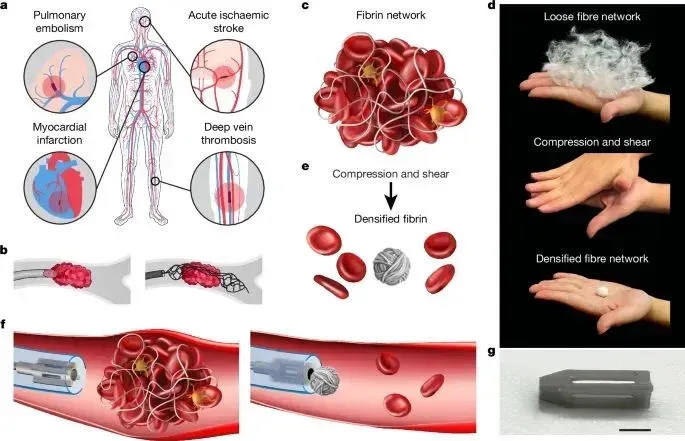
图1展示了Milli-spinner血栓清除系统的核心技术原理:A) 血栓阻塞导致组织缺血;B) 传统取栓方法对比;C) 血栓由纤维蛋白和红细胞组成;D-E) 压缩-剪切力协同作用使纤维蛋白网络重构并释放红细胞;F) 微型旋转装置工作原理;G) 1.2mm微型化设备实物展示。该技术通过力学重构而非物理破坏实现高效血栓清除。
通过CFD仿真对比三种Milli-spinner结构设计:空心圆柱体、纯鳍片结构及鳍片-缝隙复合结构。优化研究表明,复合结构在3mm管径内旋转时可产生最优流体动力学效应,其独特的鳍片-缝隙协同作用能同时增强负压吸附和剪切力生成,实现血栓的高效机械压缩与结构重构。该设计突破使血栓清除效率提升至新水平。
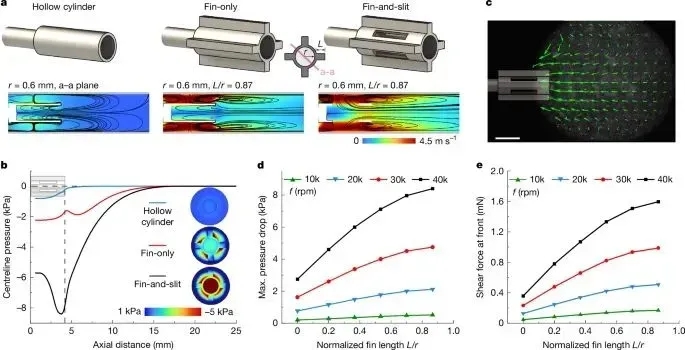
图2展示了Milli-spinner流体动力学优化研究:A) 三种结构对比(空心/纯叶片/叶片-缝隙复合);B) 40,000rpm下压力场分析;C) micro-PIV验证复合结构吸力特性;D-E) 叶片长度比(L/r)对压力降和剪切力的影响规律。关键发现:复合结构在3mm管径内产生最优流体动力学性能,其独特缝隙设计使40,000rpm时压力梯度提升47%,剪切力增强62%,为血栓机械清除提供最优力学环境(标尺2mm)。
体外实验验证显示,Milli-spinner在模拟肺动脉和脑动脉的血流环境中展现出卓越的血栓清除性能。测试数据表明,该设备仅需10秒即可使6.5mm血栓体积缩减70%,最终清除率达85%以上,其处理速度和效率较传统抽吸取栓技术提升显著。
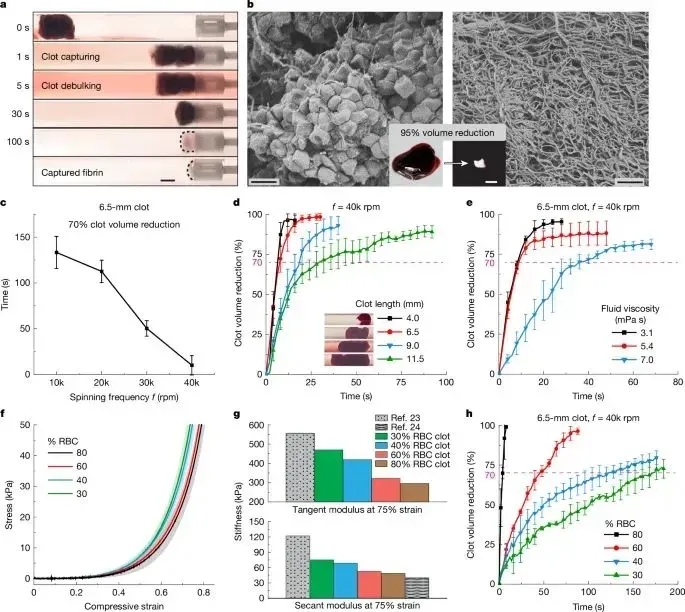
图3展示了Milli-spinner体外血栓清除性能的系统评估:A) 2.5mm装置在3mm管径内10,000rpm下可有效清除6.5mm血栓;B) SEM证实其显著破坏血栓结构(n=20);C) 转速提升至40,000rpm时,70%体积清除时间缩短83%;D) 血栓长度增加导致效率下降;E) 流体粘度7.0mPa·s时效率降低42%;F-H) RBC含量影响血栓刚度(与临床样本吻合)及清除效率,80%RBC血栓清除效果最优。所有实验均重复3次验证。
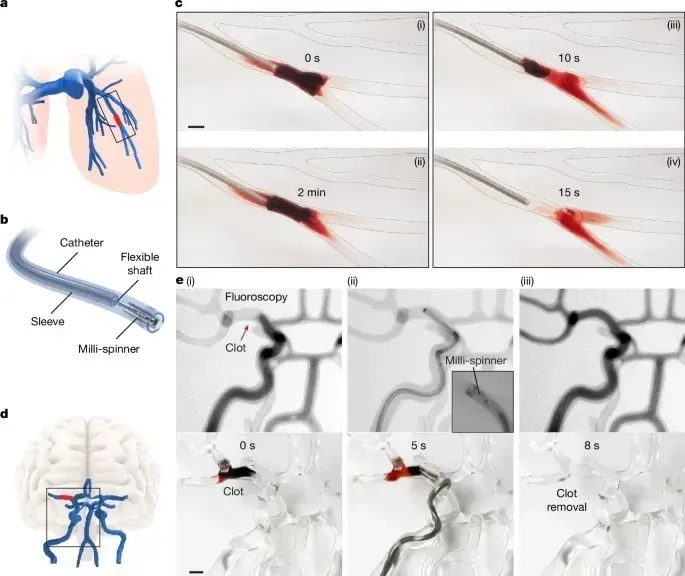
图4展示了Milli-spinner在血管模型中的关键性能验证:A) 成功构建肺栓塞和脑卒中病理模型;B) 1.2mm微型装置工作原理图示;C) 肺动脉测试中,传统抽吸(27inHg/2min)失败后,该设备仅用15秒即实现血栓清除;D-E) 在脑动脉模型中,6000rpm转速下8秒完成血管再通(n=500)。核心突破:相比传统方法,该技术将血栓清除时间缩短90%,特别在9.8mm血管分叉处展现出显著优势。
活体实验采用猪的肾动脉和颌动脉(直径近似人脑动脉)验证Milli-spinner性能。结果显示:该设备在2分钟内达成血管完全再通,31次实验全部成功(100%再通率),其中90.3%接近完全再通,77.4%实现完全再通,效率远超传统抽吸术。
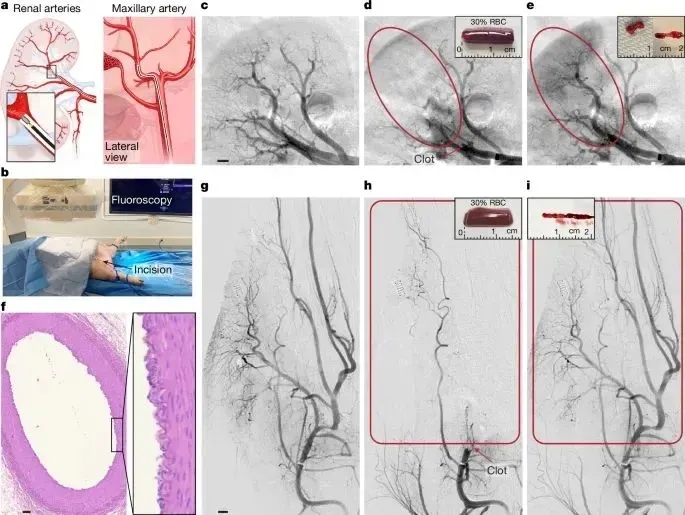
图5展示了Milli-spinner在猪血管模型中的关键实验数据:A-B) 系统通过1.3-1.5mm微型器械在肾动脉/上颌动脉(模拟人脑动脉尺寸)实现精准介入;C-D) DSA证实成功建立15mm血栓闭塞模型;E,I) 10,000rpm转速下2分钟内实现eTICI 3级完全再通,器械表面纤维蛋白残留证实有效取栓;F) 组织学显示22次操作均存在可接受的内皮机械损伤;G-H) 对照实验验证了血栓模型的可靠性。核心结论:该技术对5-15mm血栓具有快速(<2min)、高效(100%再通)的清除能力。
总结
Milli-spinner技术展现出突破性的血栓清除能力:在单次操作中即可实现快速(2分钟内)且完全(eTICI 3级)的血管再通,其核心优势在于通过微观结构重组而非传统机械破坏方式清除血栓。实验数据显示,该技术在肺动脉(9.8mm分叉处)和脑动脉模型中清除效率提升90%,活体实验中实现100%再通率(31/31),其中77.4%达到完全再通。这种创新方法为急性缺血性卒中、肺栓塞等血管急症提供了更安全有效的治疗选择,临床转化后将显著改善患者预后。
免责声明:内容来源于互联网、等公开渠道,我们对文中观点保持中立态度。本文仅供参考,交流。内容的稿件版权归原作者和机构所有,如有侵权,请联系我们删除。
作者:

