单细胞的“分选和捕获”有哪些方法?
单细胞的“分选和捕获”有哪些方法?
1. 特异性分选与非特异性分选
细胞分选技术主要分为特异性分选和非特异性分选两大类。特异性分选能够精准地识别并筛选出目标细胞,而非特异性分选则是随机捕获细胞。
1)特异性分选
特异性分选是从目标组织或样本中,利用特定的标志物(如荧光标记物或细胞形态特征)来识别并挑选出特定的目标细胞,随后对这些细胞进行测序分析。由于需要精准识别目标细胞,这种方法通常通量较低。
2)非特异性分选
非特异性分选则是一种高通量方法,通常通过特定技术从样本(通常是单细胞悬液)中随机捕获大量单个细胞,然后对这些细胞进行独立测序。之后,研究人员可以从大量单细胞数据中筛选出感兴趣的细胞类型进行后续分析。
2. 单细胞捕获分选方法
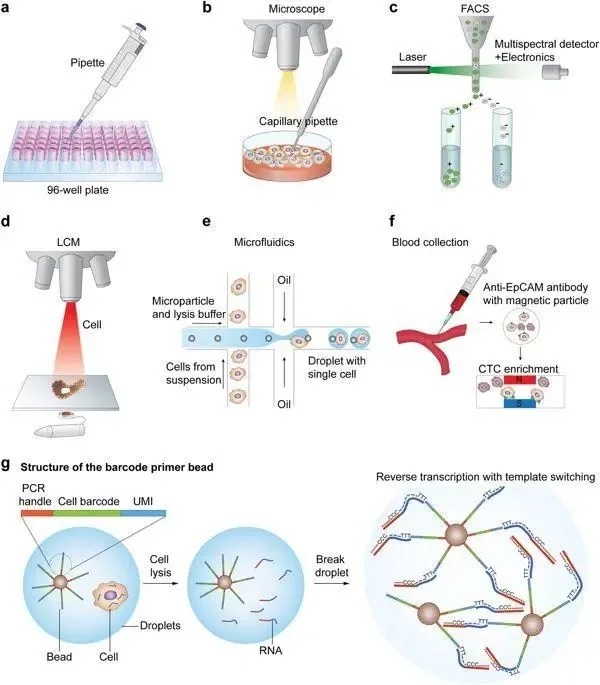
- a:微吸管分离
- b:显微镜辅助毛细管捕获
- c:荧光标记细胞分选(FACS)
- d:激光捕获显微分离(LCM)
- e:微流控
- f:抗体磁珠分选(MACS) g:微液滴
图片来源:单细胞分离技术_手机搜狐网
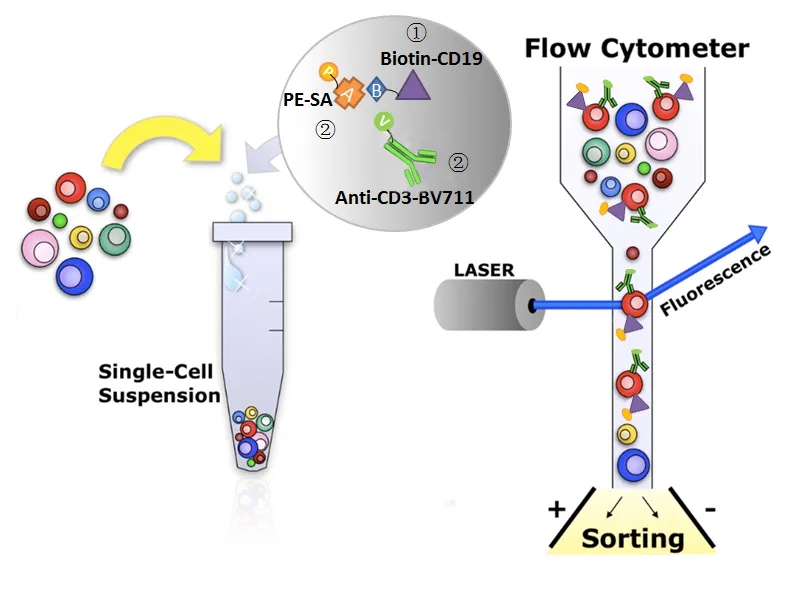
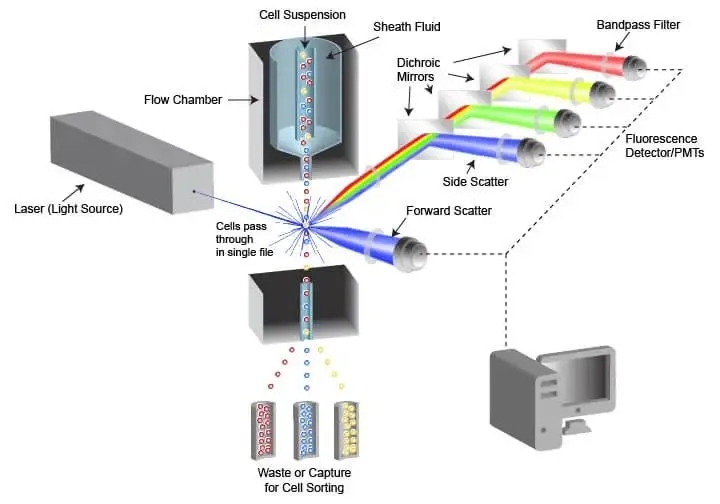
1.流式细胞术
在众多流式细胞仪类型中,荧光激活细胞分选(FACS)系统是实现单细胞分离的关键技术。
2.激光捕获显微切割
激光捕获显微切割是一项在显微镜下从组织切片中分离、纯化单一类型细胞群或单个细胞的技术。

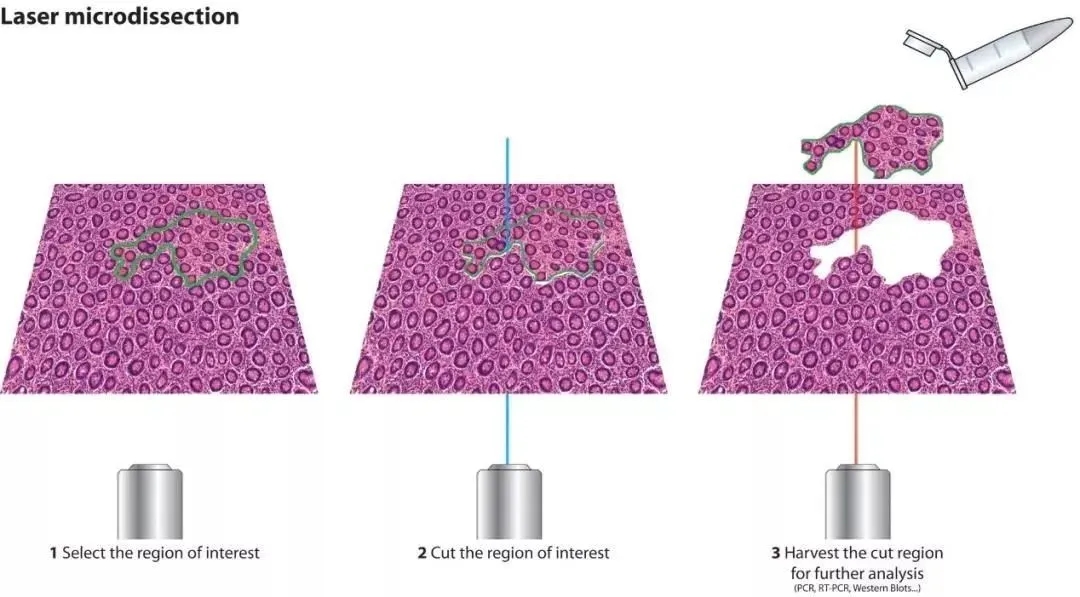
激光捕获显微切割(LCM)方法:
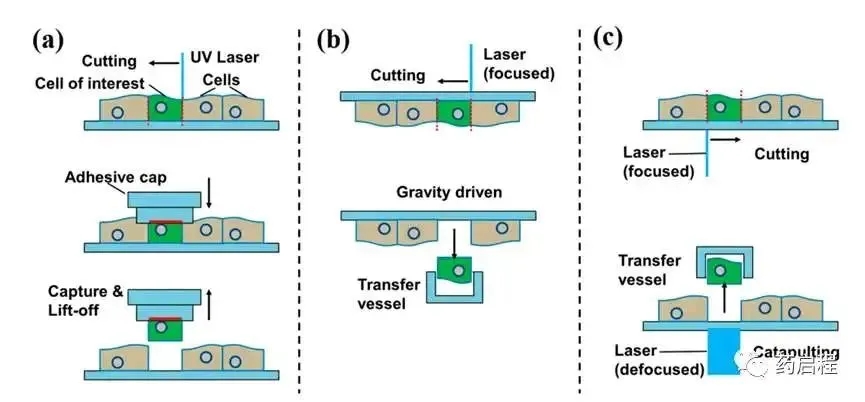
- a.通过胶带进行接触;
- b.用聚焦激光切割,然后用容器捕获(通过重力提取的切口部分);
- c.用聚焦激光切割,然后用散焦激光脉冲压力弹射。
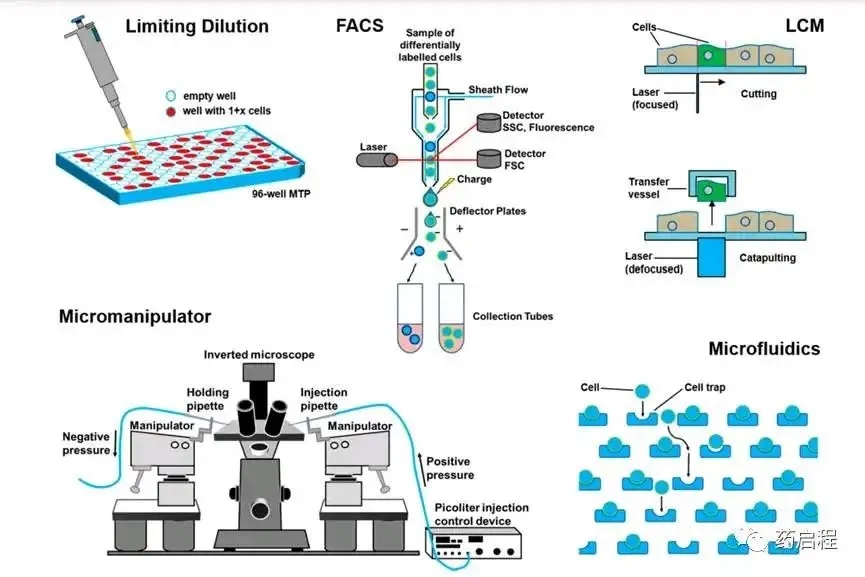
3)限制稀释
使用手动移液器或移液机器人通过稀释细胞悬液来分离单个细胞。
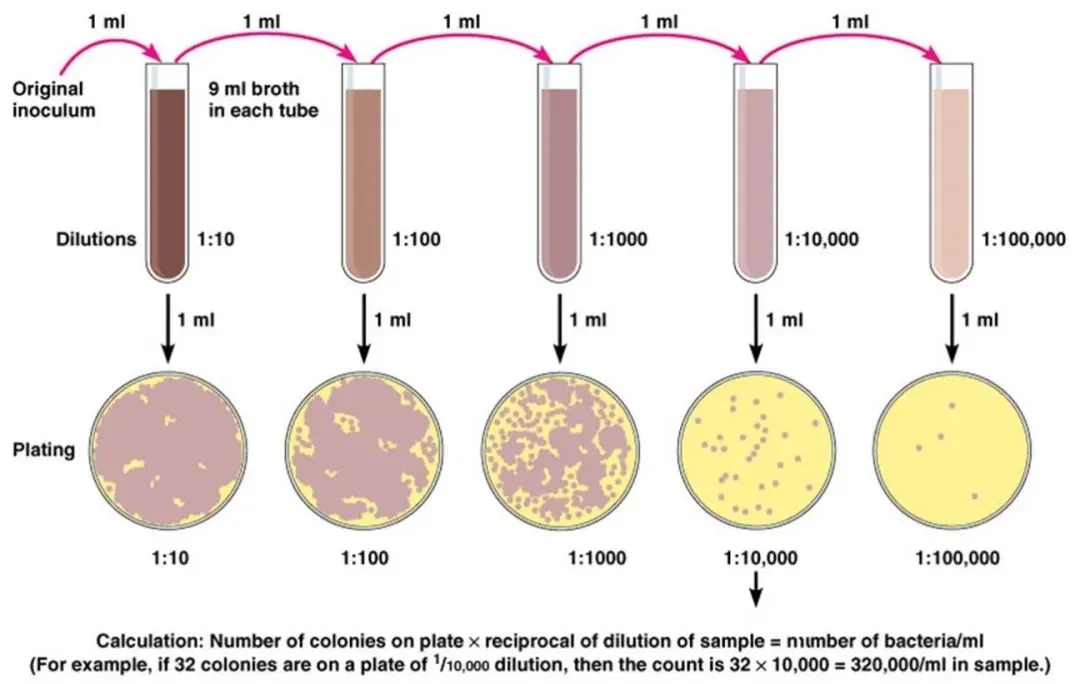
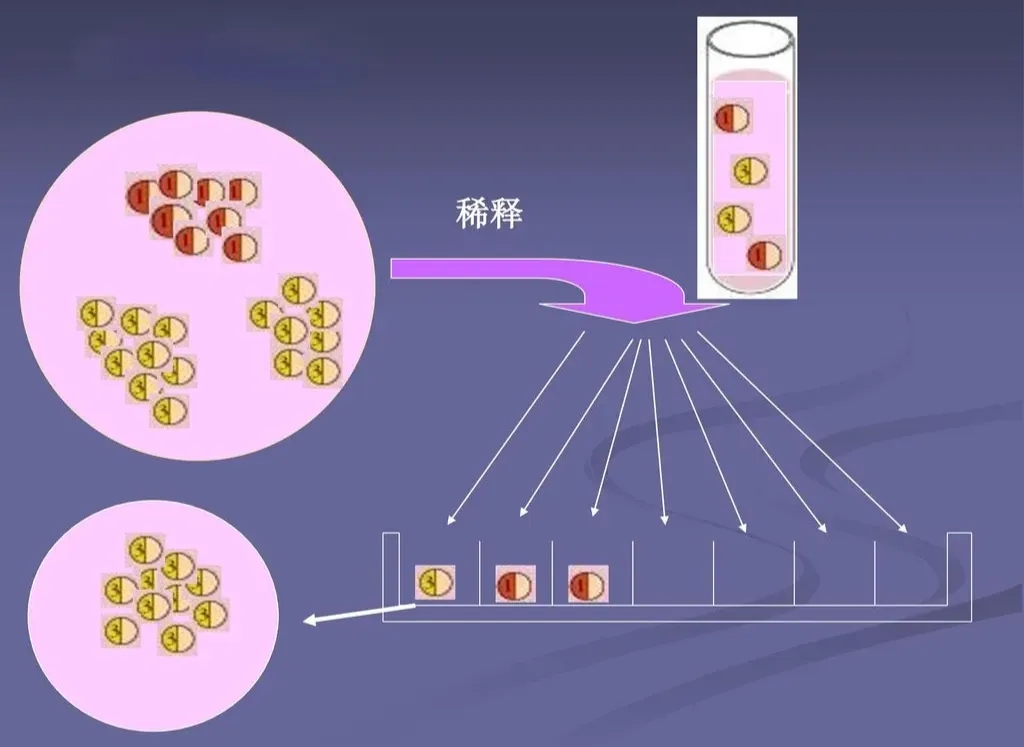
当将细胞悬浮液分成许多小体积的等分试样时,通过高度稀释可以使每个等分试样中仅包含一个单细胞,这种操作过程被称为有限稀释法。
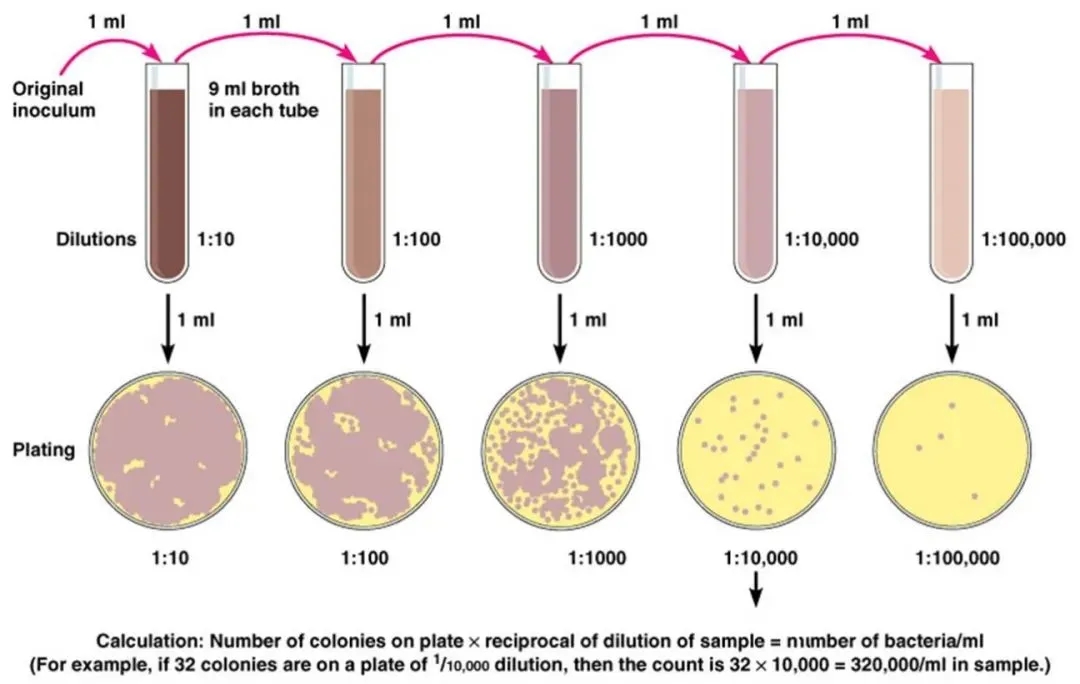
图片来源:科学网—环境微生物之生长和繁殖 - 王从彦的博文
4)手动细胞挑选
手动细胞挑选通常借助显微操作装置完成,这种装置一般包括一台倒置显微镜和一个微移液管,微移液管可以通过电动机械平台进行精确移动。

微量移液器通常由超薄玻璃毛细管制成,并且与抽吸及分配装置相连。细胞样品一般以悬浮液的形式存在于培养皿或孔板中。

4)手动细胞挑选
操作员通过显微镜观察,选定目标细胞后,将微量移液管靠近该细胞,并通过微量移液器施加吸力将其吸出。包含所选细胞的液体被吸入后,可以转移到收集容器(例如孔板的一个孔)中,并通过分配装置将其释放。这一过程通常是手动完成的。
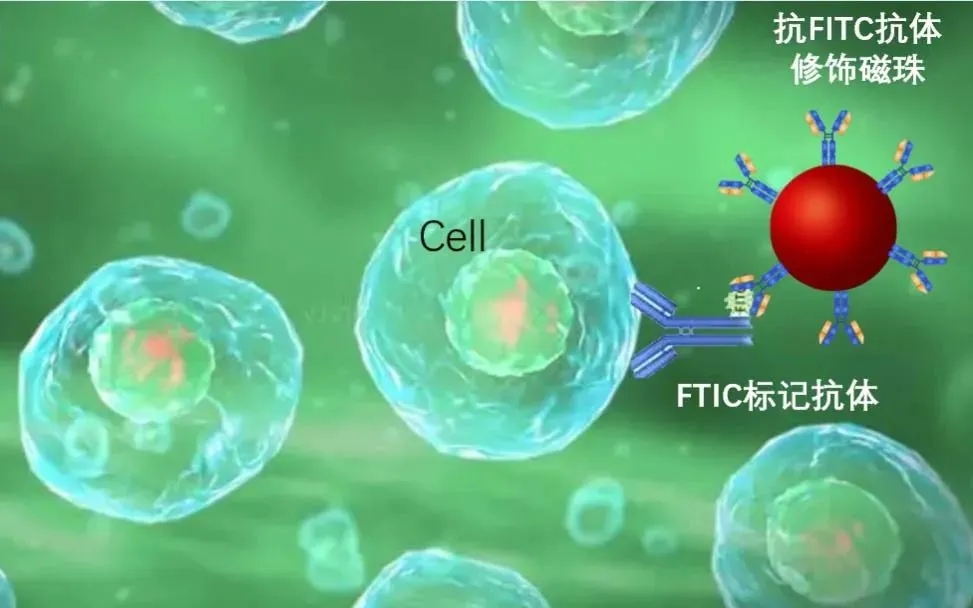
5)免疫磁珠分选(MACS)
免疫磁珠分选技术是通过将特异性抗体连接到磁珠上,这些抗体能够与细胞表面的抗原结合。当细胞悬液通过外加磁场时,与磁珠结合的细胞会被吸附并滞留在磁场中,从而实现细胞的分离和富集。
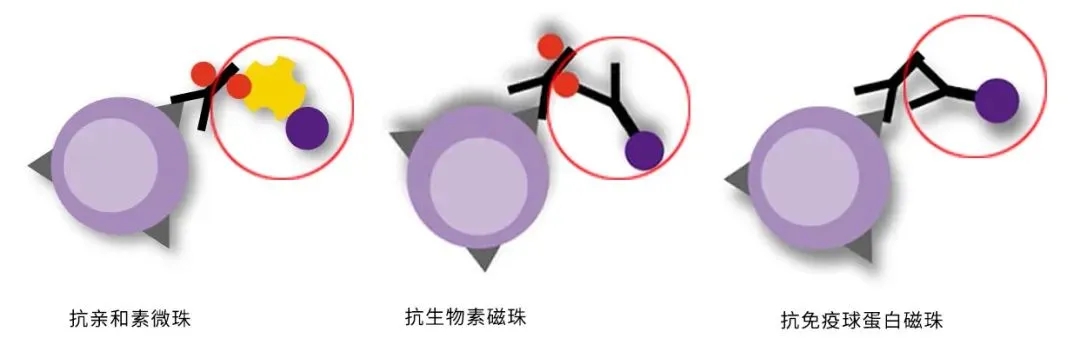
根据所标记细胞的不同,磁珠分选通常可分为阳性分选和阴性分选两类。
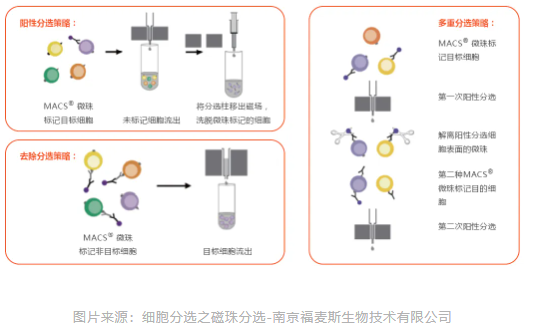
6)微流体
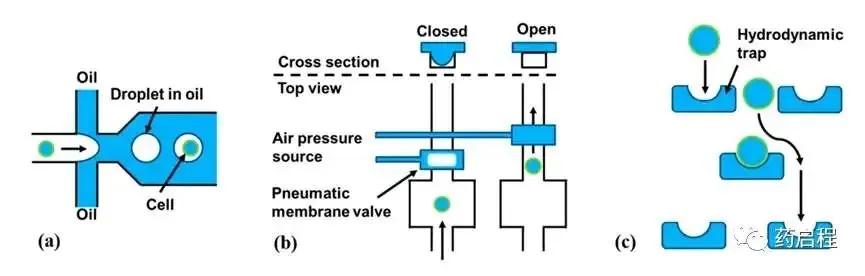
a. 液滴微流控技术
- 原理:细胞的水相流被分割成单个油包水液滴,这些液滴中随机分布着细胞。
- 机制:基于液滴的微流控技术利用充满油的通道来容纳分离的水滴(类似于乳液)。每个液滴可以包含单个细胞,从而实现细胞的隔离。
- 效率:该技术可以根据泊松分布(类似于有限稀释法)随机分离单个细胞,或者实现超过80%的分离效率。
- 优势:基于油滴的细胞分离和分选技术的最大优点是其高吞吐量,每秒可处理数千个单细胞。
b. 气动膜阀技术
- 原理:气动膜阀利用气压通过膜的偏转来关闭微流体通道。
- 机制:这种技术可以停止流体流动,从而捕获细胞。
c. 水动力捕集器
- 原理:水动力捕集器是被动元件,专门用于捕获单个细胞并将它们固定在一个位置。
- 机制:通过将陷阱的大小调整为样本中细胞的平均大小,可以最大限度地减少双重捕获的情况。此类系统可以通过大量陷阱实现对大量细胞的并行操作。
3. 三大非特异性高通量单细胞平台
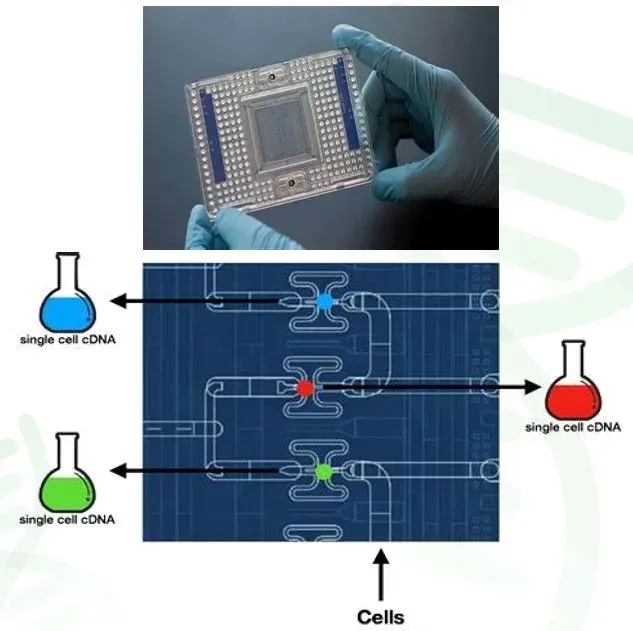
1)微流控平台
- 代表性技术:Fluidigm公司的微流控芯片Fluidigm C1。

Fluidigm C1芯片类似于一个微缩的实验室,当单细胞悬液被导入后,单个细胞会被精准地分配到各自独立的微小腔室中。每张芯片设有96个这样的腔室,因此能够同时对最多96个细胞进行平行且独立的裂解、反转录以及PCR扩增操作。
2)微液滴技术
微液滴技术的代表性产品是10x Genomics单细胞测序系统,该系统基于Drop-seq原理开发。
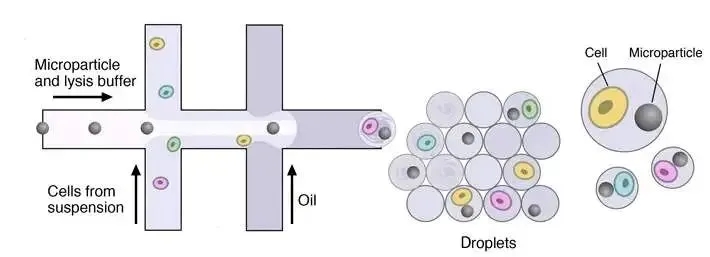
首先,将单个细胞与一个含有建库所需酶的微珠(bead)包裹在一个纳米级的液滴中。每个微珠(bead)都携带有一段独特的条形码序列(barcode),这段序列会被添加到该液滴中细胞的所有转录本序列上,从而能够区分不同细胞的转录本。

由于采用液滴包裹的形式,突破了空间限制,极大地提升了细胞捕获量。目前,单张芯片可检测的细胞数量可达3000-8000个。10x Genomics 已成为当前单细胞测序领域的主流平台。
3)微孔技术
微孔技术的典型代表是美国BD公司推出的BD Rhapsody平台。
BD的技术不再采用Drop-seq微液滴技术进行单细胞分离和捕获,转而采用Cyto-seq特有的蜂窝板技术。
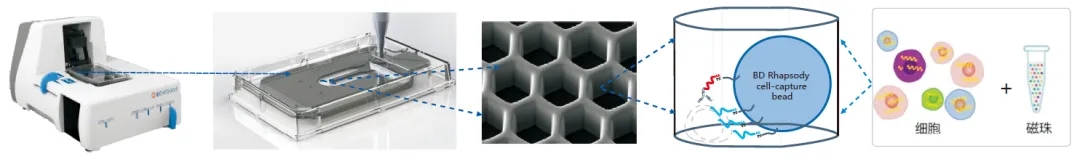

在该技术的实验流程中,首先将单细胞悬液导入蜂窝板(蜂窝板上拥有超过20万的微孔,其数量远远超过投入的细胞数),使细胞随机落入微孔中。通过严格控制导入的细胞数量,确保细胞数远少于微孔数,从而极大程度地降低两个细胞同时落入同一个微孔的概率(即避免形成多细胞团簇)。
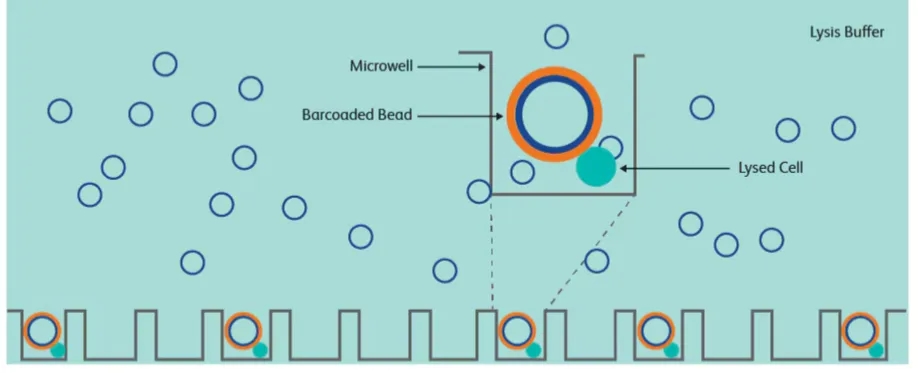
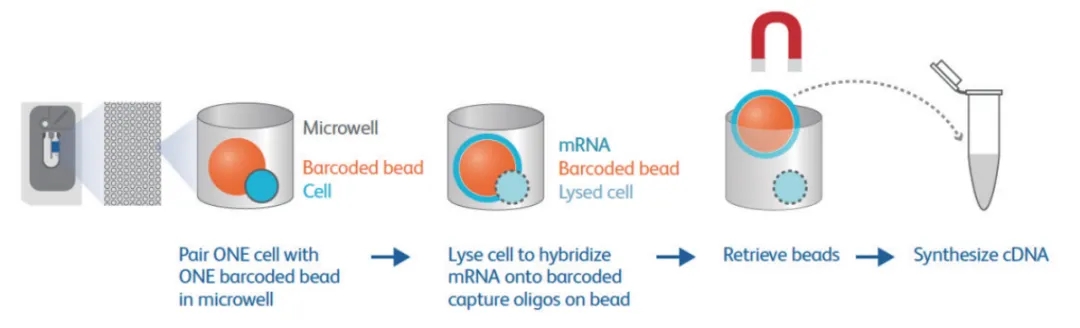
当细胞分别落入微孔后,在蜂窝板上覆盖一层微磁珠。最终在微孔中形成“磁珠-细胞-反应试剂”的体系,从而完成单个细胞的相关反应(例如转录组测序中的细胞裂解、转录组分析和扩增等过程)。
实际上,BD Rhapsody和10x Genomics的主要区别在于它们采用不同的体系来承载单细胞的分选过程(前者使用蜂窝板,后者使用微液滴),而后续的建库、测序和分析步骤则几乎完全相同。
免责声明:内容来源于互联网、等公开渠道,我们对文中观点保持中立态度。本文仅供参考,交流。内容的稿件版权归原作者和机构所有,如有侵权,请联系我们删除。
作者:

