讲配位化合物——2. EAN规则
讲配位化合物——2. EAN规则
有效原子序数(EAN)规则是针对配合物中过渡元素提出的规则,也称18电子规则或9轨道规则。该规则指出,中心体的价电子加上所有配体提供的电子若占满5个(n-1)d轨道、1个ns轨道与3个np轨道,则属于相对稳定结构。

由于d轨道位于次外层,d轨道未全部充满所带来的不稳定因素较小。所以EAN规则远不如主族元素的8电子规则普遍:主族元素不满足8电子规则可是天大的罪过(自由基),但过渡元素不满足18电子规则…….这个再正常不过啦~

1️⃣Ni(3d84s2)、Fe(3d64s2)、Cr(3d54s1)分别含10、8、6个价电子,距离18电子稳定结构还差8、10、12个电子。每个端基配位的CO能提供2个电子,故三种元素的羰基化合物分别为Ni(CO)4、Fe(CO)5与Cr(CO)6。2️⃣二茂铁是2个η6- C5H5-与Fe2+(3d6)形成的配合物,二苯铬是2个η6-C6H6与Cr(3d54s1)形成的配合物,它们也都满足18电子规则。

小学低年级数学老师告诉我们,奇数与偶数无论如何相加,得到的一定还是奇数。这意味着,对于价电子为奇数的过渡金属,靠端基配位的η2-CO注定无法形成18电子结构。不过我们可以先想办法凑成17电子结构,然后再使用下列策略:
1️⃣得到1个电子形成阴离子,例如Co(CO)4-、Mn(CO)5-、V(CO)6-,这也是金属能够实现负化合价的途径之一。
2️⃣与一个含单电子的基团相连(H或CH3自由基),例如HCo(CO)4、CH3-Mn(CO)5。
3️⃣形成含金属-金属键的二聚体,其本质也是与含单电子的基团相连,只不过这个基团与羰基配合物本身相同。例如Co2(CO)8、Mn2(CO)10。

对于空间位阻较大的配合物,也不是必须要满足18电子结构,例如V(CO)6、(C6H6)2Cr+就可以稳定维持其17电子结构。

EAN规则可以认为是“8电子规则”在过渡金属范围的补充。所以我们能像写“路易斯结构式”一样,去预测过渡金属簇合物的结构。

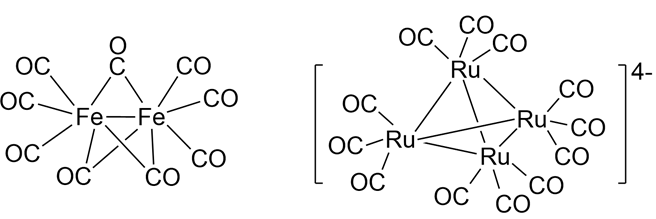
在Fe2(CO)9中,每个Fe(3d64s2)原子含8个价电子,端基的CO为Fe提供3×2=6个价电子,桥基的CO为Fe提供3×1=3个价电子,另一个Fe原子提供1个电子形成金属-金属键,故Fe原子周围价电子总数为8+6+3+1=18。
Ru4(CO)124-可视为是Ru(CO)3-单元的四聚体,每个单元的中心体周围的电子数为8(4d65s2) + 1(负电荷) + 3×2(CO配电子) = 15,距18电子结构差3个电子,故4个Ru(CO)3-单元以四面体的形式四聚。
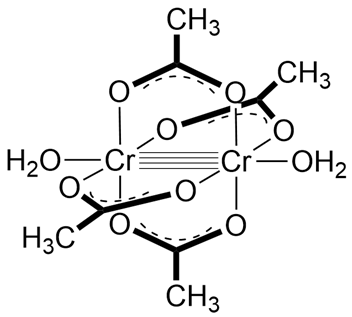
最后是水合乙酸亚铬(II)的例子:在没有金属-金属键的前提下,每个中心体的周围电子数为4(Cr2+价电子) + 4×2(乙酸根配电子) + 2(H2O配电子) = 14,距18电子结构差4个电子,故两个中心体间应形成金属-金属四重键(σ+2π+δ)。
好啦~这就是本期的内容,大家学会(fei)了嘛~
免责声明:所载内容来源互联网,我们对文中观点保持中立,仅供参考,交流之目的。转载的稿件版权归原作者和机构所有,如有侵权,请联系我们删除。
作者:

