|
| ||||||||||||||||||||||||||||||||||||||||||||||||
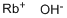
CAS号:1310-82-3
|
英文名称:Rubidium hydroxide
分子式
分子量
EINECS号
MDL
Smiles
InChIKey
乙二醇化学百科
基本信息
物化性质
安全信息
生产及用途
氢氧化铷水溶液比氢氧化钾的碱性更强,是已知的第二强碱,只与酸反应,不与碱反应,化学式RbOH。分子量102.48。灰白色固体,常结为块状,有很强的吸水性,易潮解。比重3.203。熔点301±0.9℃。易溶于水。热的浓溶液能迅速地与镍和银反应。水溶液在铂皿中减压加热至400℃可脱水成无水物。其固体与溶液均能从空气中吸收二氧化碳。由硫酸铷与氢氧化钡反应而得。可在低温使用的蓄电池中作电极,氧化氯化反应的催化剂。 金属铷与水发生爆炸性的反应,生成氢氧化铷,并放出氢气。 碘化铷与氢氧化铷的混合溶液中通入氯气,加热后能生成氯化铷和碘酸铷结晶。 硫酸铷与氢氧化钡作用,生成氢氧化铷,并析出白色硫酸钡沉淀。 氢氧化铷和二氧化碳反应或由草酸铷或酒石酸氢铷加热分解而制得碳酸铷。 以上信息由Chemicalbook的彤彤编辑整理。氢氧化铷与镁在氢气流中加热时,则能生成金属铷和氧化镁,并放出氢气。  氢氧化铷与氯气作用,不加热时生成次氯酸铷;加热时则生成氯酸铷;均能同时生成氯化铷和水。 2RbOH+Cl2=RbOCl+RbCl+H2O 6RbOH+3Cl2=RbClO3+5RbCl+3H2O 氢氧化铷与酸发生中和反应,形成相应的铷盐和水。  氢氧化铷与氢氧化铝作用,则生成四羟基合铝(Ⅲ)酸铷. RbOH+Al(OH)3=Rb[Al(OH)4] 在加热下,氢氧化铷与氯化铵作用,则生成氯化铷和水,并放出氨气. RbOH+NH4CL=RbCl+NH3+H2O 氢氧化铷与金属氯化物反应,均生成氯化铷和相应的氢氧化物或氧化物.  氢氧化铷与酸性氧化物作用,则生成水和相应的铷盐. 2RbOH+CO2=Rb2CO3+H2O 2RbOH+CrO3=Rb2CrO4+H2O每100毫升水中的溶解克数: 180g/20℃ 用途 氢氧化铷一般用于制取金属铷和各种铷盐的原料、催化剂生产、微型高能电池、含铷单晶的原材料、特种玻璃及陶瓷工业等领域。生产方法
1.可由硫酸铷与氢氧化钡作用生成硫酸钡沉淀,过滤即为含氢氧化铷的母液,经蒸发,浓缩、结晶干燥而得。
2.
使硫酸铷与等摩尔的氢氧化钡反应以制取氢氧化铷。硫酸铷与氢氧化钡的水溶液反应,反应完成后,过滤,滤液置铂皿中,在装有固体氢氧化钾真空蒸发器中蒸发浓缩。然后放在银舟中在干燥的氢气(不含CO2)流中逐渐加热至300℃除去水分。密封保存。也可用铷的氯化物进行电解以制取氢氧化铷。
类别 腐蚀物品毒性分级 中毒急性毒性 口服-大鼠 LD50: 586 毫克/公斤; 口服-小鼠 LD50: 900 毫克/公斤可燃性危险特性 遇水放出大量热助燃; 遇金属放出可燃氢气; 遇氨盐放出可燃氨气储运特性 库房通风低温干燥; 与酸、金属、氨盐、易燃物分开存放灭火剂 水、砂土
上下游产品
相关产品
产品供应商
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
本网站展示的所有产品仅用于工业制造、技术研发、科学研究,所有产品非药品不可食用,依据国家相关法规及平台管理要求,购买相关危险物品应取得有效的资质、资格条件。 参考《应急管理部等多部门关于加强互联网销售危险化学品安全管理的通知 (应急〔2022〕119号)》 和《互联网危险物品信息发布管理规定》 Copyright © 2021-2025 chemhome123版权所有 |冀ICP备2024096099号- 1|冀公安备13042302000143号|互联网增值电信业务经营许可证:冀B2-20250121 |药品、 医疗器械互联网信息服务备案凭证备案号:(冀)-非经营性-2025-0099 |


 CAS号:17194-00-2
CAS号:17194-00-2 CAS号:7488-54-2
CAS号:7488-54-2 CAS号:1309-42-8
CAS号:1309-42-8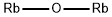 CAS号:18088-11-4
CAS号:18088-11-4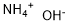 CAS号:1336-21-6
CAS号:1336-21-6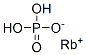 CAS号:13774-16-8
CAS号:13774-16-8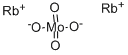 CAS号:13718-22-4
CAS号:13718-22-4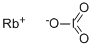 CAS号:13446-76-9
CAS号:13446-76-9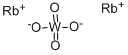 CAS号:13597-52-9
CAS号:13597-52-9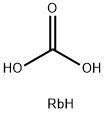 CAS号:584-09-8
CAS号:584-09-8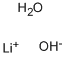 CAS号:1310-66-3
CAS号:1310-66-3 CAS号:7440-17-7
CAS号:7440-17-7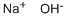 CAS号:1310-73-2
CAS号:1310-73-2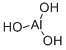 CAS号:21645-51-2
CAS号:21645-51-2 CAS号:9001-05-2
CAS号:9001-05-2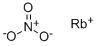 CAS号:13126-12-0
CAS号:13126-12-0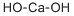 CAS号:1305-62-0
CAS号:1305-62-0